
Complemento alimenticio coadyuvante del tratamiento contra Helicobacter pylori.
Puede ayudar a mejorar la eficacia del tratamiento antibiótico y minimizar sus efectos adversos secundarios.
Complemento alimenticio a base de 3 cepas probióticas y 3 extractos fitoterápicos:
- Lactobacillus reuteri (actualmente Limosilactobacillus reuteri) (SGL 01) tindalizado, 3 x 10^9 UFC/g
- Lactobacillus rhamnosus (actualmente Lacticaseibacillus rhamnosus) (SGL 06), 5 x 10^9 UFC/g
- Bifidobacterium longum spp longum (SGB 05), 2 x 10^9 UFC/g
- Extracto seco desglicirrizado de regaliz 1:4, 100 mg
- Extracto seco de jengibre, titulado 5% en gingeroles, 80 mg
- Extracto seco de Pistacia lentiscus (masilla de Quíos), 80 mg
1. Limosilactobacillus reuteri (conocido anteriormente como Lactobacillus reuteri) (SGL 01) tindalizado
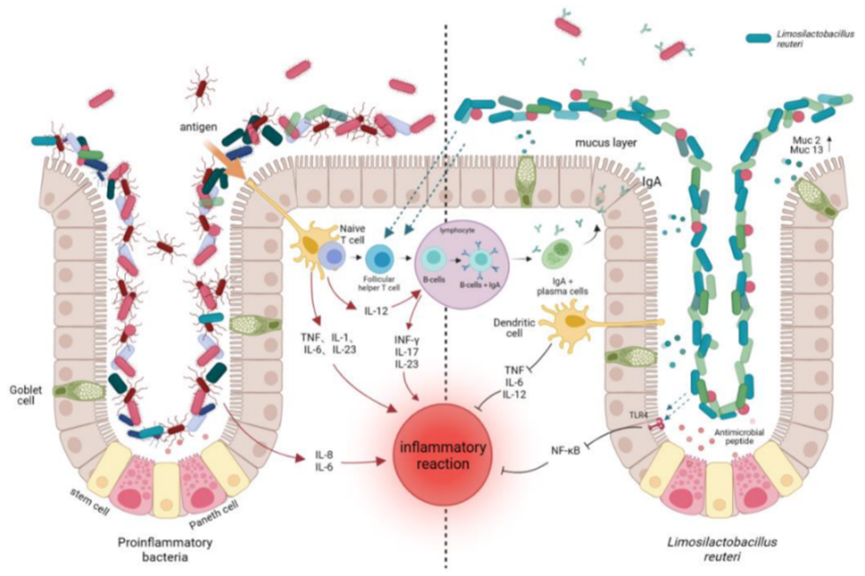
El Limosilactobacillus reuteri (L. reuteri) es conocido por sintetizar moléculas con actividad antibiótica de amplio espectro, como la reuterina, mediante la vía de fermentación del glicerol. Estas moléculas tienen la capacidad de inhibir el crecimiento de algunas bacterias Gram-negativas y Gram-positivas, junto con levaduras, hongos y protozoos.
En concreto, ha demostrado eficacia inhibiendo el crecimiento de H. pylori, como complemento al tratamiento estándar de erradicación de la bacteria. En ensayo clínico aleatorizado y controlado con placebo se evidenció que la suplementación con L. reuteri mejora la tasa de erradicación de H. pylori del 68,9% al 93,2% en comparación con placebo, además de reducir los síntomas gastrointestinales como mala digestión y dolor abdominal (1). La adición de diferentes especies de Lactobacillus como el L. reuteri no solo mejora los resultados clínicos, sino que también disminuye los efectos secundarios como náuseas y diarrea, asociados a los antibióticos utilizados en la terapia estándar (2).
Por otro lado, se ha demostrado que L. reuteri ejerce su efecto antimicrobiano sobre H. pylori principalmente mediante la producción de la reuterina. La ruta metabólica clave involucra la fermentación del glicerol, facilitada por la enzima glicerol deshidratasa, que transforma el glicerol en 3-hidroxipropionaldehído (reuterina). Este compuesto inhibe el crecimiento de H. pylori al interferir con la síntesis de ADN y de proteínas bacterianas. Además, L. reuteri modula la expresión de mucinas como MUC2 y MUC13, reforzando la barrera gástrica y protegiendo el epitelio contra la adherencia de patógenos (3).
Al tratarse de un microorganismo tindalizado, es decir, tratado térmicamente hasta alcanzar la muerte bacteriana, pero manteniendo las estructuras celulares intactas, los sobrenadantes libres de células y los componentes clave purificados restantes en la muestra pueden conferir efectos beneficiosos, principalmente efectos inmunomoduladores, protección contra enteropatógenos y mantenimiento de la integridad de la barrera intestinal, todo ello evitando la adquisición de genes de resistencia antibióticos y siendo especialmente seguro para pacientes vulnerables o poblaciones pediátricas (4).
La tindalización favorece la ruptura de paredes celulares de los microorganismos una vez se encuentran en el intestino del paciente, suponiendo la liberación de contenidos citoplasmáticos (lisados bacterianos), como el ADN; y componentes de la pared celular, como peptidoglicanos o ácidos lipoteicoicos. Estas sustancias desempeñan funciones inmunomoduladoras clave y también pueden tener un papel en la inhibición de patógenos (5).
2. Lacticaseibacillus rhamnosus (conocido anteriormente como Lactobacillus rhamnosus) (SGL 06)
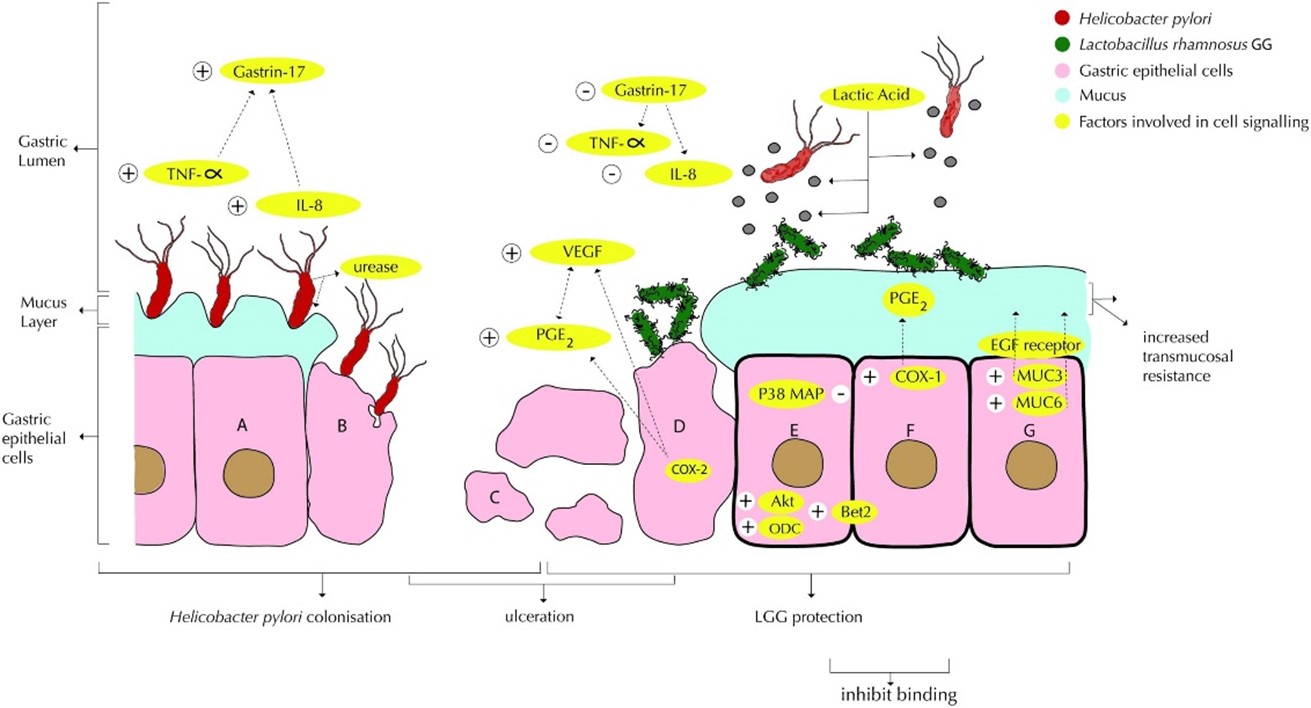
La suplementación con Lactocaseibacillus rhamnosus (L. rhamnosus) parece mejorar las tasas de erradicación de H. pylori y reducir los efectos adversos del tratamiento con antibióticos, como la diarrea y distensión abdominal. Su efecto se debe a su capacidad para modular la microbiota gástrica y disminuir la inflamación provocada por la bacteria (2).
Se ha demostrado que los probióticos, incluidos Lactobacillus y otras bacterias del ácido láctico, inhiben una amplia gama de enteropatógenos, incluidos E. coli, Salmonella, H. pylori, Listeria monocytogenes y rotavirus (5). También se ha demostrado que las cepas probióticas de las especies de Lactobacillus reducen la formación de biopelículas en estas bacterias patógena a través de la competencia, la exclusión y el desplazamiento (6).
Concretamente, L. rhamnosus inhibe la adhesión del H. pylori a la mucosa gástrica por mecanismos competitivos de unión. Tiene la capacidad de reducir la expresión de proteínas clave en la liberación de citoquinas proinflamatorias como TNF-α e IL-8. La reducción de estas moléculas disminuye la respuesta inflamatoria y promueve la restauración de la barrera epitelial gástrica dañada por H. pylori (7).
3. Bifidobacterium longum spp. longum (SGB 05)
Bifidobacterium longum (B. longum) ha sido identificado como un probiótico con actividad contra H. pylori. Diversos estudios indican que puede inhibir la adherencia de Helicobacter a las células epiteliales y disminuir la inflamación de la mucosa gástrica. Un metaanálisis reciente resalta que diferentes cepas de Bifidobacterium, incluida B. longum, mejoran significativamente las tasas de erradicación y reducen los efectos secundarios de los tratamientos convencionales. (8)
- longum ejerce su efecto beneficioso a través de la producción de ácidos grasos de cadena corta (AGCC), como el butirato, mediante la fermentación de carbohidratos a través de la vía Embden-Meyerhof-Parnas. Estos AGCC promueven la reparación de la mucosa gástrica y reducen la inflamación al modular las rutas metabólicas implicadas (9).
Se ha sugerido, además, que una baja abundancia de Bifidobacterium en la microbiota intestinal está asociada con mayor presencia de úlceras y cáncer gástricos asociados a H. pylori, por lo que una presencia adecuada de estas bacterias podría suponer un papel protector contra dichas condiciones (10).
4. Extracto seco desglicirrizado de regaliz
El regaliz desglicirrizado ha demostrado propiedades antiulcerosas y antiinflamatorias, que lo convierten en un aliado útil en el tratamiento de H. pylori. Este extracto promueve la cicatrización de las úlceras gástricas y mejora la respuesta a la terapia triple antibiótica al reducir la actividad inflamatoria inducida por H. pylori (11). La característica de ser desglicirrizado es una ventaja, ya que la ausencia de glicirricina evita los efectos hipertensivos propios del regaliz estándar, haciéndolo seguro para su uso prolongado (12).
Este tipo de regaliz contiene flavonoides como la glabridina, que actúan como inhibidores de la vía de la ciclooxigenasa (COX-2) y de la lipoxigenasa (LOX), reduciendo así la síntesis de prostaglandinas proinflamatorias. Además, estos flavonoides tienen capacidad antioxidante y protegen la mucosa gástrica del daño inducido por H. pylori al neutralizar especies reactivas de oxígeno (ROS) generadas durante la infección (13).
5. Extracto seco de jengibre (titulado 5% en gingeroles)
El extracto de jengibre, estandarizado al 5% en gingeroles, presenta propiedades antiinflamatorias y antibacterianas. Estudios tanto in vitro como in vivo han demostrado que los gingeroles inhiben el crecimiento de H. pylori y reducen la inflamación gástrica al modular las citoquinas proinflamatorias (14).
El jengibre, rico en 6-gingerol y 10-gingerol, inhibe la activación del factor nuclear kappa B (NF-κB), que regula la transcripción de ADN, y reduce la expresión de genes proinflamatorios como IL-1β, TNF-α y COX-2. De esta forma, actúa limitando la inflamación gástrica y protegiendo la integridad de la mucosa contra el daño causado por H. pylori. También mejora la producción de mucinas gástricas, fortaleciendo la barrera protectora natural del estómago (15).
6. Extracto seco de Pistacia lentiscus o lentisco (Masilla de Quíos)
El lentisco es una resina natural con propiedades antibacterianas reconocidas contra H. pylori. Ensayos clínicos han evidenciado que la masilla reduce la carga bacteriana y mejora los síntomas gastrointestinales, como dispepsia y dolor abdominal, incluso cuando se utiliza como monoterapia (16). Su actividad antimicrobiana y antiinflamatoria la convierte en un excelente complemento de los tratamientos convencionales.
La capacidad del lentisco para eliminar la presencia de H. pylori parece atribuirse a la síntesis de proteínas arabinogalactanos, inhibidoras de la actividad de neutrófilos que activa la presencia de esta bacteria. En varias ocasiones se ha demostrado que la masilla es suficiente por si sola para lograr la erradicación in vivo de H. pylori, aunque parece necesitar un ambiente ácido estomacal para ser efectiva, condición compleja de alcanzar en presencia de tratamiento con inhibidores de la bomba de protones (17).
BIBLIOGRAFÍA
- Ismail, Nur Izreena, et al. «IDDF2022-ABS-0107 The effect of lactobacillus reuteri probiotic as an adjunct treatment for helicobacter pylori infection in adults.» (2022): A9-A10. https://gut.bmj.com/content/71/Suppl_2/A9
- Lü, Muhan, et al. «Efficacy of probiotic supplementation therapy for Helicobacter pylori eradication: a meta-analysis of randomized controlled trials.» PloS one10 (2016): e0163743. https://doi.org/10.1371/journal.pone.0163743
- Jiang, Jiayan, et al. «Limosilactobacillus reuteri regulating intestinal function: a review.» Fermentation1 (2022): 19. https://doi.org/10.3390/fermentation9010019
- Piqué, Núria, Mercedes Berlanga, and David Miñana-Galbis. «Health benefits of heat-killed (Tyndallized) probiotics: an overview.» International journal of molecular sciences10 (2019): 2534. https://doi.org/10.3390/ijms20102534
- Lee, Seung‐Hun, et al. «Therapeutic effect of tyndallized Lactobacillus rhamnosus IDCC 3201 on atopic dermatitis mediated by down‐regulation of immunoglobulin E in NC/Nga mice.» Microbiology and immunology7 (2016): 468-476. https://doi.org/10.1111/1348-0421.12390
- Woo, J., and J. Ahn. «Probiotic‐mediated competition, exclusion and displacement in biofilm formation by food‐borne pathogens.» Letters in applied microbiology4 (2013): 307-313. https://doi.org/10.1111/lam.12051
- Westerik, Nieke, et al. «The probiotic Lactobacillus rhamnosus for alleviation of Helicobacter pylori-associated gastric pathology in East Africa.» Frontiers in Microbiology9 (2018): 1873. https://doi.org/10.3389/fmicb.2018.01873
- Chitapanarux, Taned, et al. «Effect of Bifidobacterium longum on PPI-based triple therapy for eradication of Helicobacter pylori: a randomized, double-blind placebo-controlled study.» Journal of Functional Foods13 (2015): 289-294. https://www.sciencedirect.com/science/article/abs/pii/S1756464615000079
- Rivière, Audrey, et al. «Bifidobacteria and butyrate-producing colon bacteria: importance and strategies for their stimulation in the human gut.» Frontiers in microbiology7 (2016): 979. https://doi.org/10.3389/fmicb.2016.00979
- Devi, T. Barani, et al. «Low Bifidobacterium abundance in the lower gut microbiota is associated with Helicobacter pylori-related gastric ulcer and gastric cancer.» Frontiers in microbiology12 (2021): 631140. https://doi.org/10.3389/fmicb.2021.631140
- Momeni, Ali, et al. «Effect of licorice versus bismuth on eradication of Helicobacter pylori in patients with peptic ulcer disease.» Pharmacognosy research4 (2014): 341. https://doi.org/10.4103/0974-8490.13828910.4103/0974-8490.138289
- Isbrucker, R. A., and G. A. Burdock. «Risk and safety assessment on the consumption of Licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin.» Regulatory Toxicology and Pharmacology3 (2006): 167-192. https://doi.org/10.1016/j.yrtph.2006.06.002
- Takahashi, Tetsuyuki, et al. «Isoliquiritigenin, a flavonoid from licorice, reduces prostaglandin E2 and nitric oxide, causes apoptosis, and suppresses aberrant crypt foci development.» Cancer Science5 (2004): 448-453. https://doi.org/10.1111/j.1349-7006.2004.tb03230.x
- Gaus, Kristen, et al. «Standardized ginger (Zingiber officinale) extract reduces bacterial load and suppresses acute and chronic inflammation in Mongolian gerbils infected with cagA+ Helicobacter pylori.» Pharmaceutical biology1 (2009): 92-98. https://doi.org/10.1080/13880200802448690
- Ho, Su-Chen, Ku-Shang Chang, and Chih-Cheng Lin. «Anti-neuroinflammatory capacity of fresh ginger is attributed mainly to 10-gingerol.» Food chemistry3 (2013): 3183-3191. https://doi.org/10.1016/j.foodchem.2013.06.010
- Dabos, Konstantinos J., et al. «Is Chios mastic gum effective in the treatment of functional dyspepsia? A prospective randomised double-blind placebo controlled trial.» Journal of ethnopharmacology2 (2010): 205-209. https://doi.org/10.1016/j.jep.2009.11.021
- Soulaidopoulos, Stergios, et al. «Overview of chios mastic gum (Pistacia lentiscus) effects on human health.» Nutrients3 (2022): 590. https://doi.org/10.3390/nu14030590