
Complemento alimenticio de utilidad para el restablecimiento de la microbiota en procesos de gastroenteritis que cursan con inflamación o tras un tratamiento antibiótico
Complemento alimenticio a base de 4 cepas probióticas (10×9 UFC/g) y 2 extractos fitoterápicos:
- Lactobacillus plantarum (Lactiplantibacillus plantarum) (SGL 07), 2 x 10^9 UFC/g
- Lactobacillus acidophilus (SGL 11), 2 x 10^9 UFC/g
- Bifidobacterium longum spp infantis (SGB 05), 1 x 10^9 UFC/g
- Bifidobacterium longum spp longum (SGB 03), 2 x 10^9 UFC/g
- Extracto seco de hinojo titulado 0,5% en aceite esencial, 200mg
- Extracto seco de cúrcuma, titulado 95% en curcuminoides, 200 mg
1. Lactiplantibacillus plantarum (anteriormente conocido como Lactobacillus plantarum) (SGL 07)
Lactiplantibacillus plantarum (L. plantarum) es una bacteria probiótica Grampositiva con propiedades beneficiosas demostradas para la restauración de la microbiota intestinal tras los tratamientos antibióticos. Esta cepa ha mostrado capacidad para adherirse a la mucosa intestinal, compitiendo con especies patógenas y facilitando el restablecimiento del equilibrio microbiano alterado y la homeostasis intestinal. Además, presenta actividad antiinflamatoria mediante la modulación de citoquinas proinflamatorias como IL-4, IL-10 y TNF-α, reduciendo así el daño a la mucosa intestinal y el malestar digestivo asociado a la disbiosis (1). Un estudio demostró que L. plantarum reduce los síntomas gastrointestinales, como la distensión abdominal y el dolor, en pacientes con síndrome del intestino irritable (SII) y otros trastornos funcionales del tracto digestivo (2).
Por otra parte, estudios recientes destacan el efecto antioxidante de L. plantarum al reducir el estrés oxidativo en la mucosa intestinal, que podría atribuirse a la expresión de enzimas antioxidantes mediada por la vía del factor de transcripción Nrf2, lo que lo convierte en un candidato óptimo para el tratamiento de patologías inflamatorias crónicas del tracto digestivo (3).
Existen estudios en los que se demuestra que L. plantarum suprime eficazmente la adhesión de H. pylori en ensayos de inhibición, competencia y desplazamiento, mostrando una tasa deinhibición del 70.1%. Este estudio documentó algunas de las funciones de L.plantarum frente al H. pylori, como son la inhibición de la expresión de los genes de virulencia de H. pylori o la reducción del nivel de interleucina 8 (IL-8), protegiendo frente al daño inflamatorio (4).
2. Lactobacillus acidophilus (SGL 11)
Lactobacillus acidophilus (L. acidophilus) es una especie probiótica ampliamente estudiada por sus efectos beneficiosos sobre la salud digestiva y la microbiota intestinal. Su uso tras los tratamientos antibacterianos facilita la recolonización de la mucosa intestinal, aumentando la producción de ácido láctico, y creando un ambiente desfavorable para el crecimiento de patógenos (5). Además, L. acidophilus ha demostrado reducir la inflamación local al modular la respuesta inmunitaria, disminuyendo la expresión de citoquinas inflamatorias como TNF-α, disminuyendo la permeabilidad intestinal al reducir el efecto de las citoquinas sobre las uniones estrechas epiteliales (6).
Además, hay evidencias de que el L. acidophilus puede tener implicación en la mejora de la absorción del calcio y la osteoporosis, por medio de la secreción de metabolitos activos durante la fermentación de hidratos de carbono, como la indicaxantina, el ácido clorogénico y la 3-hidroximelatonina (7). El calcio es considerado un cofactor crucial para la digestión eficiente de las enzimas pancreáticas, cuya actividad depende críticamente de la presencia de iones Ca2+ a una concentración de 5-10 mM (8).
3. Bifidobacterium longum spp. infantis (SGB 05)
Bifidobacterium longum spp. infantis es una cepa clave en la restauración de la microbiota intestinal, especialmente en estados de disbiosis inducidos por antibióticos. Se ha observado su capacidad para degradar oligosacáridos complejos y fomentar la producción de ácidos grasos de cadena corta (AGCC), como butirato, que poseen propiedades antiinflamatorias y favorecen la integridad de la barrera intestinal (9). Diversos estudios clínicos han evidenciado una reducción significativa de los síntomas de inflamación intestinal y dolor abdominal en pacientes con enfermedades digestivas funcionales y orgánicas, como el SII o la colitis ulcerosa leve (10).
Esta cepa también modula positivamente el sistema inmunitario al inducir la producción de IL-10, una citoquina antiinflamatoria, lo que ayuda a contrarrestar el proceso inflamatorio en pacientes con enfermedades intestinales crónicas (11). Además, su efecto prebiótico promueve el crecimiento de otras bacterias beneficiosas, contribuyendo a la restauración de un ecosistema microbiano saludable.
4. Bifidobacterium longum spp. longum (SGB 03)
Bifidobacterium longum spp. longum facilita la recuperación de la microbiota intestinal post-tratamiento con antibióticos, al promover la fermentación de carbohidratos complejos y la producción de ácidos grasos de cadena corta (AGCC), como el butirato. Estos metabolitos no solo nutren el epitelio intestinal, sino que también inhiben vías proinflamatorias como el factor nuclear kappa B (NF-kB), reduciendo citoquinas proinflamatorias (IL-6 e IL-8). Esto fortalece la barrera intestinal y mejora síntomas como diarrea y distensión abdominal asociados con la disbiosis (12).
Asimismo, esta cepa contribuye a la recolonización microbiana por especies beneficiosas al competir con patógenos por el nicho ecológico intestinal. Su acción mejora la diversidad bacteriana y estabiliza el pH intestinal, lo que facilita el equilibrio del ecosistema intestinal. Hay varios estudios que han demostrado que su administración acelera la recuperación de especies bacterianas comensales y reduce el malestar digestivo, ofreciendo un efecto antiinflamatorio clínicamente relevante (13).
5. Extracto seco de hinojo titulado 0,5% en aceite esencial
El extracto de hinojo (Foeniculum vulgare), con una titulación del 0,5% de aceite esencial (fracción volátil activa), contiene compuestos como anetol, fenchona y estragol. Estas moléculas le confieren propiedades carminativas, antiespasmódicas y antiinflamatorias, ayudando a relajar la musculatura lisa del tracto gastrointestinal y a reducir los espasmos intestinales, la distensión abdominal y las flatulencias, síntomas que pueden aparecer durante y tras una gastroenteritis o un tratamiento antibiótico. Existe evidencia suficiente sobre las propiedades beneficiosas que confiere el hinojo a nivel digestivo y, especialmente, en el caso de la dispepsia funcional, mejorando la motilidad intestinal y aliviando el malestar intestinal (14).
Además, el hinojo presenta actividad antioxidante y antimicrobiana, que favorece la modulación de la microbiota intestinal y disminuye la inflamación de la mucosa. Este compuesto ha demostrado efectos fungicidas significativos contra hongos como Candida albicans, siendo eficaz en concentraciones bajas (15). Esto hace que el hinojo sea útil en el manejo de disbiosis intestinales y como coadyuvante en la recuperación del equilibrio microbiano y la homeostasis intestinal, particularmente después del uso prolongado de antibióticos.
6. Extracto seco de cúrcuma, titulado 95% en curcuminoides
La cúrcuma (Curcuma longa) es conocida por su potente actividad antioxidante y antimicrobiana, atribuida principalmente a su compuesto activo, la curcumina. La curcumina tiene la capacidad de neutralizar especies reactivas de oxígeno (ROS) y nitrógeno (RNS), como radicales libres, superóxidos y peróxidos, protegiendo las células del daño oxidativo. Su efecto antioxidante se debe a su estructura fenólica, que le permite interceptar y neutralizar prooxidantes y carcinógenos, además de inducir proteínas citoprotectoras como las heat shock proteins (HSP) (16).
Por otro lado, este compuesto es conocido por sus potentes propiedades antiinflamatorias, que se deben, en gran parte, a su capacidad para modular diversas vías de señalización relacionadas con la inflamación, como la inhibición del factor nuclear kappa B (NF-κB) y la reducción de citoquinas proinflamatorias, incluyendo TNF-α, IL-1β y IL-6. Además, la curcumina también bloquea enzimas proinflamatorias como la ciclooxigenasa-2 (COX-2) y la lipooxigenasa, lo que disminuye la producción de mediadores inflamatorios como las prostaglandinas y los leucotrienos (17).
Estas propiedades hacen que la cúrcuma sea un agente terapéutico útil para controlar la inflamación crónica y proteger la integridad de la mucosa intestinal en casos de disbiosis y otras patologías digestivas.
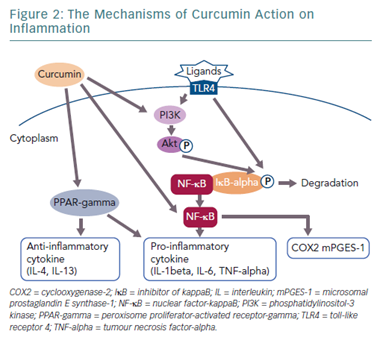
Cabe destacar que se ha estudiado el uso de suplementos combinados de hinojo y cúrcuma, demostrando mejoras significativas en los síntomas gastrointestinales, así como en la calidad de vida, de pacientes con disbiosis o síndrome de Intestino Irritable (SII), manteniendo una toma de 30 días consecutivos de ambos extractos (18).
BIBLIOGRAFÍA
- Mujagic, Zlatan, et al. «The effects of Lactobacillus plantarum on small intestinal barrier function and mucosal gene transcription; a randomized double-blind placebo controlled trial.» Scientific reports1 (2017): 40128. https://www.nature.com/articles/srep40128
- Niedzielin, Krzysztof, Hubert Kordecki, and Boz ena Birkenfeld. «A controlled, double-blind, randomized study on the efficacy of Lactobacillus plantarum 299V in patients with irritable bowel syndrome.» European journal of gastroenterology & hepatology10 (2001): 1143-1147. https://journals.lww.com/eurojgh/abstract/2001/10000/a_controlled,_double_blind,_randomized_study_on.4.aspx
- Gao, Dawei, Zhengrong Gao, and Guanghua Zhu. «Antioxidant effects of Lactobacillus plantarum via activation of transcription factor Nrf2.» Food & function6 (2013): 982-989. https://pubs.rsc.org/en/content/articlelanding/2013/fo/c3fo30316k/unauth
- Wu, Shiying, et al. «Lactiplantibacillus plantarum ZJ316 reduces Helicobacter pylori adhesion and inflammation by inhibiting the expression of adhesin and urease genes.» Molecular Nutrition & Food Research18 (2023): 2300241. https://doi.org/10.1002/mnfr.202300241
- Karska-Wysocki, Barbara, Mari Bazo, and Wanda Smoragiewicz. «Antibacterial activity of Lactobacillus acidophilus and Lactobacillus casei against methicillin-resistant Staphylococcus aureus (MRSA).» Microbiological research8 (2010): 674-686. https://www.sciencedirect.com/science/article/pii/S0944501309001116
- Haque, Mohammad, et al. «Lactobacillus acidophilus inhibits the TNF-α-induced increase in intestinal epithelial tight junction permeability via a TLR-2 and PI3K-dependent inhibition of NF-κB activation.» Frontiers in Immunology15 (2024): 1348010. https://doi.org/10.3389/fimmu.2024.1348010
- Zhou, Junhua, et al. «Lactobacillus acidophilus (LA) Fermenting astragalus polysaccharides (aps) improves calcium absorption and osteoporosis by altering gut microbiota.» Foods2 (2023): 275. https://doi.org/10.3390/foods12020275
- Eich, Torsten, et al. «Calcium: a crucial potentiator for efficient enzyme digestion of the human pancreas.» Cell Transplantation7 (2018): 1031-1038. https://doi.org/10.1177/09636897187793
- Rivière, Audrey, et al. «Bifidobacteria and butyrate-producing colon bacteria: importance and strategies for their stimulation in the human gut.» Frontiers in microbiology7 (2016): 979. https://doi.org/10.3389/fmicb.2016.00979
- Yuan, Fuqiang, et al. «Efficacy of Bifidobacterium infantis 35624 in patients with irritable bowel syndrome: a meta-analysis.» Current medical research and opinion7 (2017): 1191-1197. https://doi.org/10.1080/03007995.2017.1292230
- Konieczna, Patrycja, et al. «Portrait of an immunoregulatory Bifidobacterium.» Gut microbes3 (2012): 261-266. https://doi.org/10.4161/gmic.20358
- Kim, Hye In, et al. «Lactobacillus plantarum LC27 and Bifidobacterium longum LC67 simultaneously alleviate high-fat diet-induced colitis, endotoxemia, liver steatosis, and obesity in mice.» Nutrition research67 (2019): 78-89. https://doi.org/10.1016/j.nutres.2019.03.008
- O’Callaghan, Amy, and Douwe Van Sinderen. «Bifidobacteria and their role as members of the human gut microbiota.» Frontiers in microbiology7 (2016): 925. https://doi.org/10.3389/fmicb.2016.00925
- Samimi, Soodabeh, et al. «The Efficacy of a Traditional Herbal Medicine Compound for Functional Dyspepsia: A Randomized, Double-Blind, Placebo-Controlled Trial.» Jundishapur Journal of Natural Pharmaceutical Products4. https://doi.org/10.5812/jjnpp-148163
- Singh, Shubham Pratap. «A comprehensive review on pharmacological activity of Foeniculum vulgare.» Global Journal of Pharmacy & Pharmaceutical Sciences1 (2019): 23-27. https://ideas.repec.org/a/adp/jgjpps/v7y2019i1p23-27.html
- Bengmark, Stig, M. Mesa, and A. Gil. «Efectos saludables de la cúrcuma y de los curcuminoides.» Nutrición Hospitalaria3 (2009): 273-281. https://scielo.isciii.es/scielo.php?pid=S0212-16112009000300003&script=sci_arttext&tlng=pt
- Rahaman, Md Moshiur, et al. «The genus curcuma and inflammation: overview of the pharmacological perspectives.» Plants1 (2020): 63. https://doi.org/10.3390/plants10010063
- Portincasa, Piero, et al. «Curcumin and Fennel Essential Oil Improve Symptoms and Quality of Life in Patients with Irritable Bowel Syndrome.» Journal of Gastrointestinal & Liver Diseases2 (2016). http://dx.doi.org/10.15403/jgld.2014.1121.252.ccm
Figura: Shimizu, Kana, et al. «Anti-inflammatory action of curcumin and its use in the treatment of lifestyle-related diseases.» European Cardiology Review 14.2 (2019): 117. https://pmc.ncbi.nlm.nih.gov/articles/PMC6659038/