Papel de diferentes especies de Candida en la patogénesis, la regulación inmunitaria y las herramientas pronósticas para el tratamiento de la colitis ulcerosa y la enfermedad de Crohn
Role of Candida species in pathogenesis, immune regulation, and prognostic tools for managing ulcerative colitis and Crohn’s disease.
Patnaik, Supriti, et al. «Role of Candida species in pathogenesis, immune regulation, and prognostic tools for managing ulcerative colitis and Crohn’s disease.» World Journal of Gastroenterology 30.48 (2024): 5212.
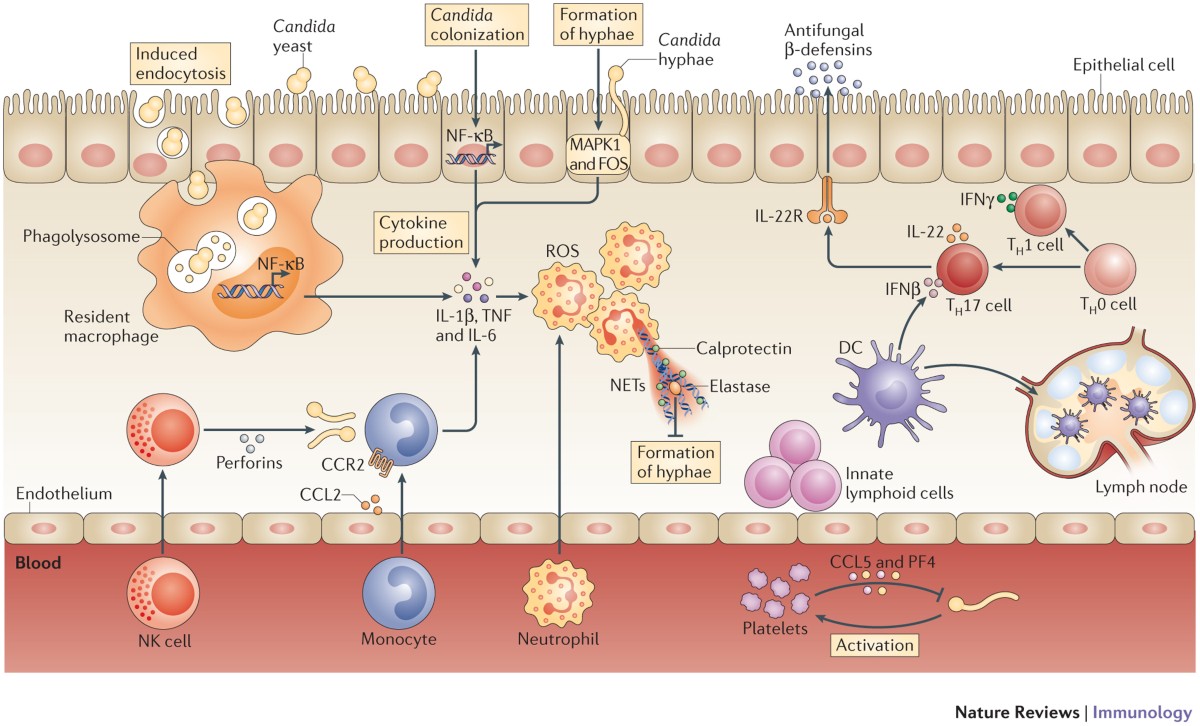
El microbioma intestinal desempeña un papel clave en la patogénesis y la actividad patológica de la enfermedad inflamatoria intestinal (EII). Hallazgos recientes indican que varias cepas de Candida albicans exhiben diferencias considerables en los factores de virulencia, lo que afecta la fisiopatología de la EII. La disbiosis fúngica intestinal y la inmunidad antifúngica de la mucosa pueden estar asociadas a la EII, especialmente a la enfermedad de Crohn.
Este artículo analiza la disbiosis fúngica intestinal y la inmunidad antifúngica en individuos sanos y pacientes con enfermedad de Crohn (EC).
Candida es el género más dominante en muestras de biopsias fecales o mucosas de pacientes con enfermedad inflamatoria intestinal (EII). Candida albicans (C. albicans) se considera la levadura comensal más importante en el intestino humano, aunque otras subespecies pueden causar candidiasis mucocutánea o sistémica en condiciones que comprometen el sistema inmunológico del huésped. Los niveles de C. albicans y C. parapsilosis se elevan sistemáticamente en las muestras fecales de pacientes con EC, mientras que la abundancia de C. tropicalis varía entre los diferentes estudios.
Respecto a la regulación inmunitaria generada por hongos intestinales, los anticuerpos anti-Saccharomyces cerevisiae (ASCA), se han utilizado para definir subgrupos de EII, relacionando la presencia de hongos con la inflamación intestinal. Específicamente, C. albicans en el tracto gastrointestinal actúa como un inmunógeno para ASCA, induciendo anticuerpos antifúngicos. El potencial patogénico de las hifas de C. albicans se basa principalmente en su capacidad para invadir la capa de células epiteliales y liberar enzimas citolíticas. Además, el crecimiento de hifas ayuda a la evasión inmunitaria al facilitar el escape de los fagocitos después de la ingestión.
Por otro lado, la IgA secretora (sIgA) es crucial para la inmunidad intestinal y la homeostasis y recubre los microorganismos para modular las respuestas inmunitarias del huésped a comensales y patógenos. La IgA antifúngica es inducida principalmente por C. albicans filamentosos en el intestino grueso, dirigiéndose a la formación de hifas, adhesinas y candidalisina. La intervención con sIgA reduce las hifas de C. albicans y promueve el crecimiento de levaduras. Además, la investigación ha demostrado una disminución de los anti-C. albicans sIgA contra factores de virulencia de hifas, junto con un aumento en la morfología de las hifas dentro de la mucosa intestinal de pacientes con EC . Los pacientes con EC muestran respuestas antifúngicas IgA más bajas a los factores de virulencia de las hifas, lo que contribuye a la patogenicidad de C. albicans en la EII.
Por tanto, esta revisión sugiere que hongos específicos pueden interactuar con el sistema inmunitario del huésped e influir en las vías inflamatorias, exacerbando los síntomas de la EII.
